类风湿性关节炎动物模型及SKG小鼠简介(上)
2023-05-08
类风湿性关节炎(Rheumatoid arthritis, RA)是一种由自身免疫失调引起的长期性慢性炎症,影响全世界大约 1% 的人口,主要表现为对称性的多关节结构损伤和功能丧失,并可能同时伴随包括皮肤、血管、心脏、肺部、肌肉等在内的关节外组织的病变。RA是一种病因尚未明确的系统性疾病,其发病原因与遗传、表观遗传和环境等多种因素密切相关。目前,研究者已经从细胞因子(白细胞介素IL、肿瘤坏死因子TNF等)、免疫细胞(T细胞、B细胞等)、性别、遗传、病原体感染等不同的层面探索了RA的发病机制、药物靶点以及治疗效果。RA动物模型可以帮助科研工作者开展更有效的研究工作,大概分为两种:一种是利用诱导剂诱导动物发生关节炎,第二种是自发性关节炎模型。
(一)诱导性关节炎模型根据其使用的不同诱导剂又可分为佐剂性关节炎(Adjuvant arthritis,AA)模型,胶原诱导性关节炎(Collagen- induced Arthritis, CIA)模型,卵清蛋白(Ovalbumin,OVA)诱导的关节炎模型,II型胶原抗体诱导性关节炎(Collagen-antibody-inducedarthritis, CAIA)模型, 酵母聚糖 A(zymosan A)诱导性关节炎模型等。
1. 佐剂性关节炎(Adjuvant arthritis,AA)模型
简介:建立该模型时,将乳化好的完全佐剂注入动物足跖皮下,注射部位将首先出现红肿等炎症表现,并逐渐扩展到足垫、全足,对侧足关节出现肿胀等继发病变,并不断加重。动物耳朵和尾根部出现与人RA类似的结节,关节及其周围软组织发炎,滑骨增生,软骨损伤,关节间隙变窄出现粘连,最终形成不可逆的关节形变导致其功能受损。该建模方法多用于大鼠。
特点:AA模型的建模方法简单易行,临床表现、病理学及免疫学特点与人类RA有很多相似之处,但其缺乏人类RA的慢性病理发展过程,有一定的局限性。
2. 胶原诱导性关节炎(Collagen- induced Arthritis, CIA)模型
简介:该模型以II型胶原为诱导剂,通过抗原刺激引起动物自身免疫反应诱导产生关节炎,并在体内形成II型胶原的抗体,导致持续性炎症反应,出现关节红肿、滑膜增生、炎性细胞浸润、血管翳形成、关节及周围软骨坏损。
特点:CIA模型与人类RA的病情发展和临床表现更相似,是目前公认的RA最佳模型,常应用于免疫学、治疗效果评价及药物筛选等方面的研究中。利用该方法建模的动物多为大鼠和小鼠。但是,CIA模型实在一定实验处理后形成的疾病,不会出现病情波动和复发的情况,没有出现RA的皮下结节、浆膜炎、血管炎等表型。
3. 卵清蛋白(Ovalbumin,OVA)诱导的关节炎模型
简介:该模型以OVA为外源性抗原,动物皮下注射后激活补体产生局部滑膜炎症反应,并引起T细胞免疫反应,导致炎性细胞浸润滑膜,诱导血管翳形成,进而产生关节及周围软骨坏损。
特点:OVA模型建模方法简单易行,适合兔、羊等动物较大病变关节的研究。该模型的局限性在于,其病理过程虽与人类RA相似,但是免疫学检测指标与人类RA有明显的差异。
4. II型胶原抗体诱导性关节炎(Collagen-antibody-inducedarthritis, CAIA)模型
简介:该模型通过注射II型胶原抗体诱导关节炎的发生,发病部位出现大量的中性粒细胞浸润,并伴随关节及周围软骨的损坏,血管翳的形成以及纤维蛋白的沉积。后期可以注射脂多糖增加疾病的发生率和严重程度。
特点:CAIA模型是抗体诱导型关节炎模型中比较常用的一种,可以被用来研究基因、年龄、性别以及效应细胞在关节炎终末阶段发病机制中的影响。但有研究表明,CAIA模型的建立与某些类群的T细胞、B细胞无关,与人类RA的病理机制存在一定的差异。
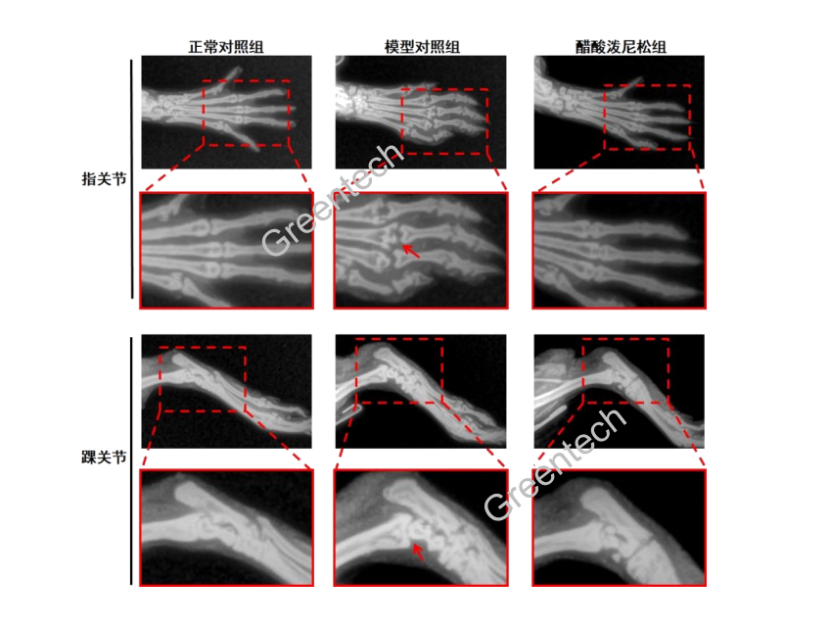
1、CIA模型,以及醋酸泼尼松治疗组的组织病理学X光片
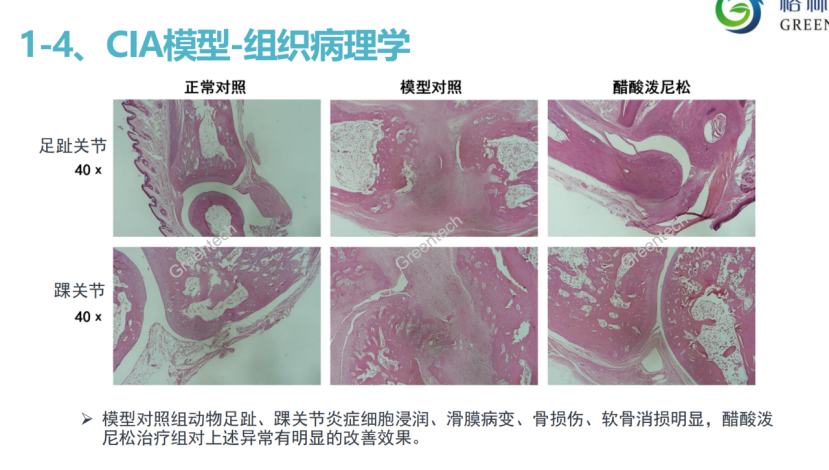
图2、CIA模型,以及醋酸泼尼松的组织病理学
(以上图片均来自格林泰科生物科技有限公司)
(二)自发性关节炎模型是利用转基因技术将外源重组基因整合在动物体基因组内使其可以稳定遗传。常用的转基因小鼠模型有K/BxN模型、人TNF-a转基因模型、IL-1Ra基因敲除小鼠模型、TS1×HA CII模型等。
1. K/BxN模型
简介:该模型是携带有TCR基因的KRN转基因小鼠与非肥胖糖尿病(Non-obese diabetes,NOD)小鼠杂交的后代。在3周龄左右,小鼠出现对称性关节炎,其组织病理表型与人类RA相似,最先表现为关节肿胀,并最终发展成关节的损伤和畸形。
特点:该模型血清中存在大量自身抗体,诱导关节损伤。其中,诱导小鼠发生关节炎的关键性致病抗体为自身葡萄糖-6-磷酸异构酶(Glueose-6-phoshate-isomearse,GPI)诱导T细胞、B细胞产生的抗GPI抗体。该模型主要用于研究自身抗体在RA产生中的作用。
2. 人TNF-a转基因模型
简介:该模型的建立是通过在小鼠体内表达经过3’ UTR区域修饰的人源TNF –a基因完成的。小鼠在4周左右可以出现自发性慢性炎症,主要症状表现为对称性关节炎、血管翳增生、关节及周围软骨损坏等,与人类RA临床表现相似。同时,该模型的小鼠还表现出小肠透壁性炎症、生长缓慢等症状。
特点:该模型建立成功的概率很高,并且个体间有很高的同质性,有利于探索TNF-a抑制剂对RA的治疗效果。
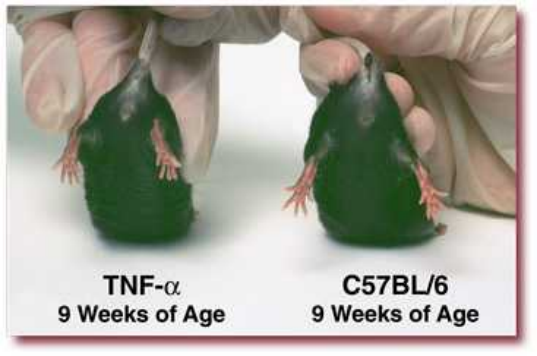
9周:轻度疾病;足趾灵活性局部丧失;最小关节肿胀、变形
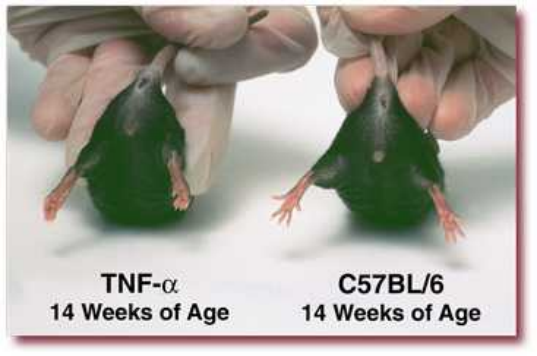
14周:中度疾病;后肢中度变形和扭曲,关节中度肿大
20周:重度疾病;关节变形、肿胀
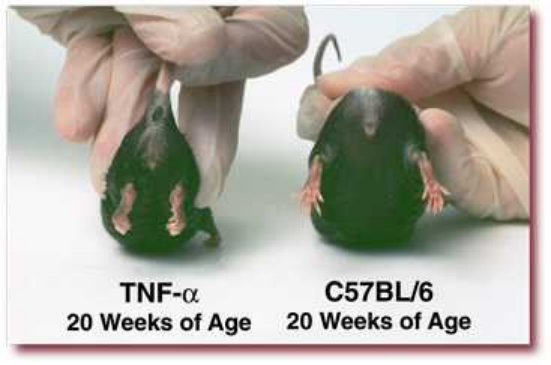
(以上图片来自tac)
3. IL-1Ra基因敲除小鼠模型
简介:该模型小鼠的基因组中,IL-1受体拮抗剂(IL-1Ra)基因被敲除,从而解除了对促炎细胞因子IL-1激活其受体引发炎症的限制。IL-1Ra基因缺失突变体小鼠与BALB/c小鼠的后代出现自发性关节炎,具体表现为炎症细胞浸润、滑膜细胞增殖、血管翳形成、关节及周围软骨组织损伤。
特点:IL-1Ra基因敲除小鼠模型的病理表型与人类RA相似,并且其关节中类风湿因子以及IL-6、TNF-a等炎症因子表达上调,T细胞在发病过程中也起到了核心作用。
4. TS1×HAC II模型
简介:该模型的建立需要HAC II转基因小鼠与TS1小鼠交配培育产生后代。该小鼠含有靶向抗原血凝素 (HA)的 CD4+ T 细胞,并由 MHC II 类启动子驱动共表达 HA。尽管受到多种耐受机制的影响,但其自身活化的 CD4+ T 细胞在该小鼠的外周血中积聚并促进全身促炎细胞因子的产生。后代中的大部分小鼠将产生自发性关节炎,主要表现为长期的关节肿胀。另外,该模型小鼠还表现出部分人类RA患者会出现的间质性肺炎等关节外病变特征。小鼠从大约 6 周龄开始出现依赖 T 细胞和不依赖 B 细胞的外周关节炎、肺炎和心脏炎症,严重程度逐渐恶化。
特点:大多数成年 TS1 × HACII 小鼠也会自发地发展为自身免疫性关节炎。疾病的发展伴随着全身细胞因子的产生和 B 细胞的激活,并且在该小鼠主要关节的淋巴结 (LN) 中会产生增强的免疫反应。但研究表明,关节炎可以在缺乏 B 细胞和/或重组酶激活基因活性的 TS1 × HACII 小鼠中发展,表明疾病的发展不依赖自身抗体的产生。使得该模型不能用于研究B细胞在关节炎发展中的调控作用。
在各种动物模型中,本文推荐的SKG动物模型的病理进程与表现和人类RA最为相似,且建模方式简单易行,是目前研究RA的最佳模式动物。以下进行详细介绍: