CRISPR基因编辑
2022-08-14
CRISPR-Pro技术原理
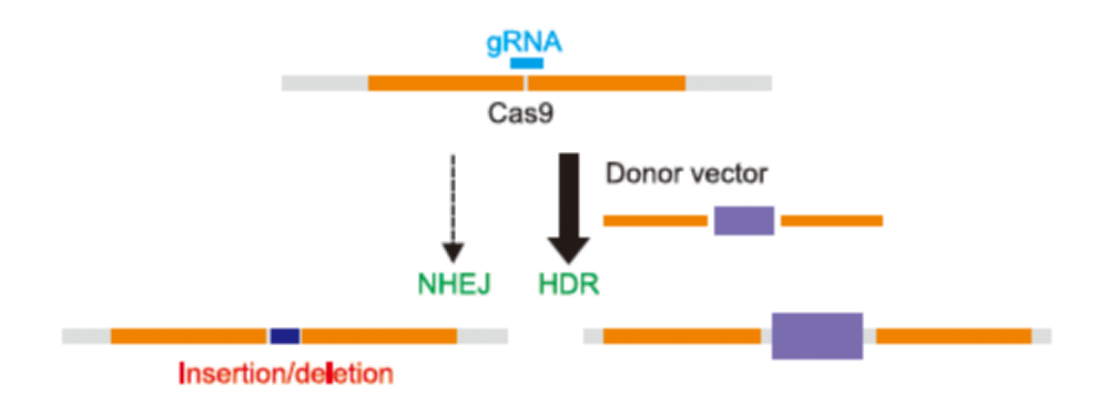
Cas9/gRNA复合物在靶位点进行切割,产生双链断裂(DSB:Double-strand break),迫使细胞进行紧急修复。通常条件下,细胞偏向于使用非同源末端连接(NHEJ:nonhomologous DNA end joining)的方式对断裂的双链进行修复,进而造成靶位点基因的插入/缺失突变。CRISPR-Pro技术采用独特的受精卵处理方式让受精卵偏好同源重组修复路径,大大提高同源重组效率,使得DNA大片段敲入(KI)及条件性敲除(cKO)得以实现。
CRISPR-Pro技术优势
1)周期短,效率高;
2)高嵌合率,生殖遗传稳定;
3)可实现DNA大片段敲入(长达15Kb);
4)可实现条件性敲除(长达4kb);
5)可实现大片段敲除(长达500kb)。
都更具优势。
CRISPR-Pro基因敲除常用小鼠模型
完全性基因敲除小鼠
CRISPR-Pro完全性基因敲除小鼠是通过CRISPR /Cas9基因敲除技术,针对靶基因设计和构建gRNA与Cas9表达质粒,造成目的基因的功能区域被敲除,获得全身所有的组织和细胞中都不表达该基因的小鼠模型。
CRISPR-Pro完全性基因敲除包括:移码突变、片段基因敲除、双/多基因敲除。
条件性基因敲除小鼠
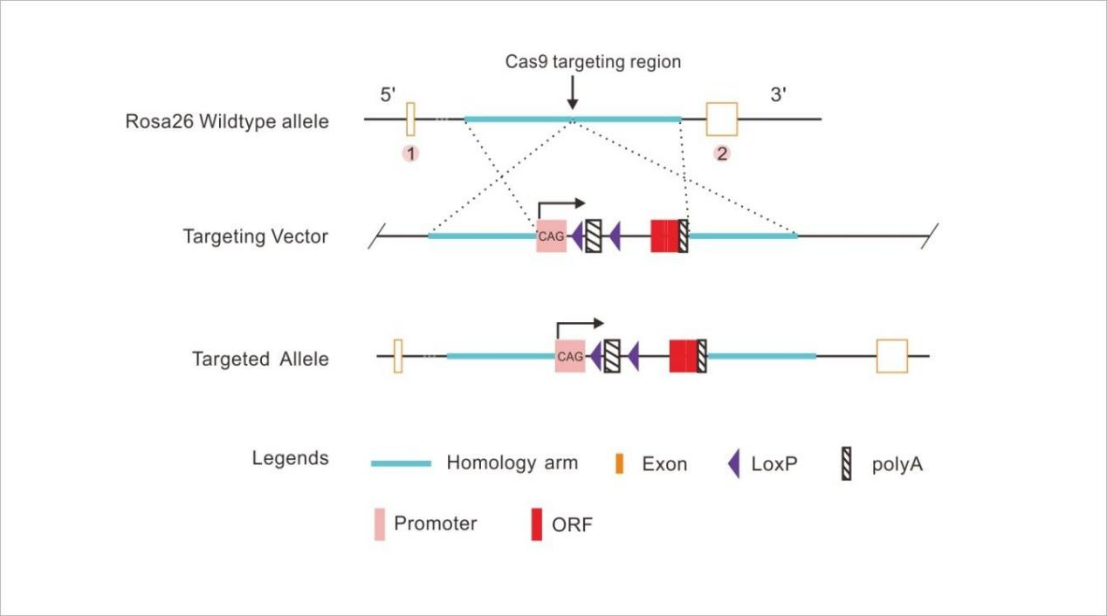
条件性基因敲除是通过把两个LoxP位点插入到目的基因的一个或几个重要外显子的两端以制备出有两个floxed小鼠。该floxed小鼠在与表达Cre重组酶小鼠杂交之前,该基因表达正常;当floxed小鼠与组织特异性表达Cre酶的小鼠进行杂交后,可实现在特定的组织或细胞中敲除该基因,而在其它组织或细胞中该基因表达正常。
基因敲入小鼠
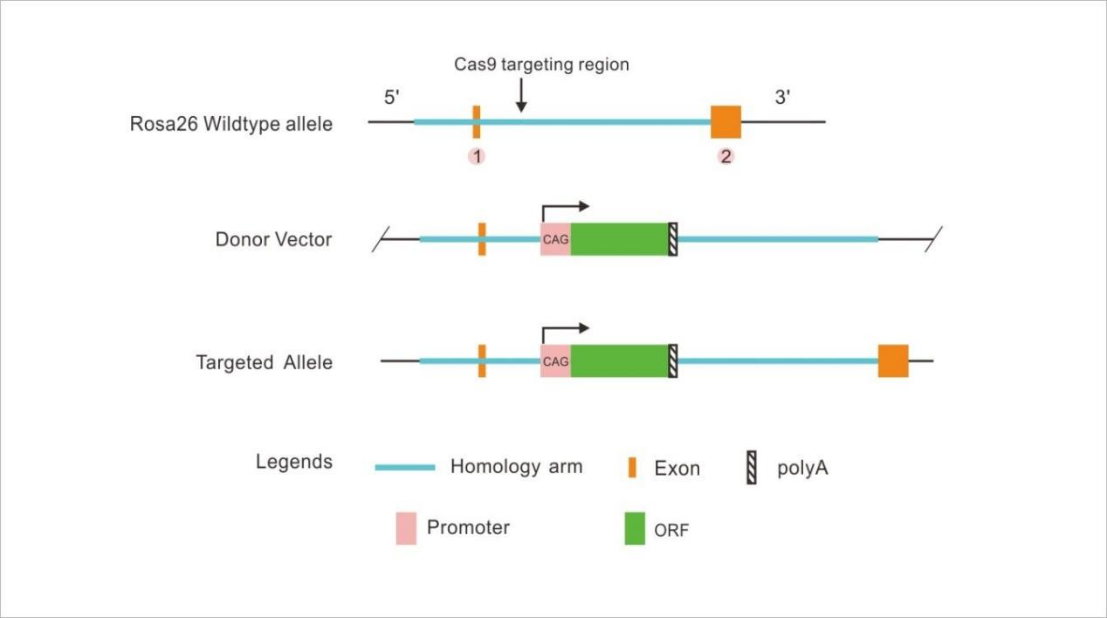
CRISPR-Pro基因敲入小鼠是利用CRISPR/Cas9基因敲入技术,针对靶基因设计、构建相应的 gRNA质粒和donor vector,通过Cas9核酸酶的切割作用和同源臂的同源重组,引入特定的突变或外源基因。比如在目的基因上引入点突变(模拟人类遗传疾病模型)或将报告基因(如EGFP,mRFP,mCherry,mYFP,或LacZ等)引入目的基因的特定位点,从而可以通过报告基因来跟踪目标基因的表达;也可以用报告基因取代大小鼠本身的基因,使KO/KI同时发生。
构建原理图:
Rosa26位点基因敲入(基于CRISPR技术)
Rosa26位点条件性基因敲入(基于CRISPR技术)
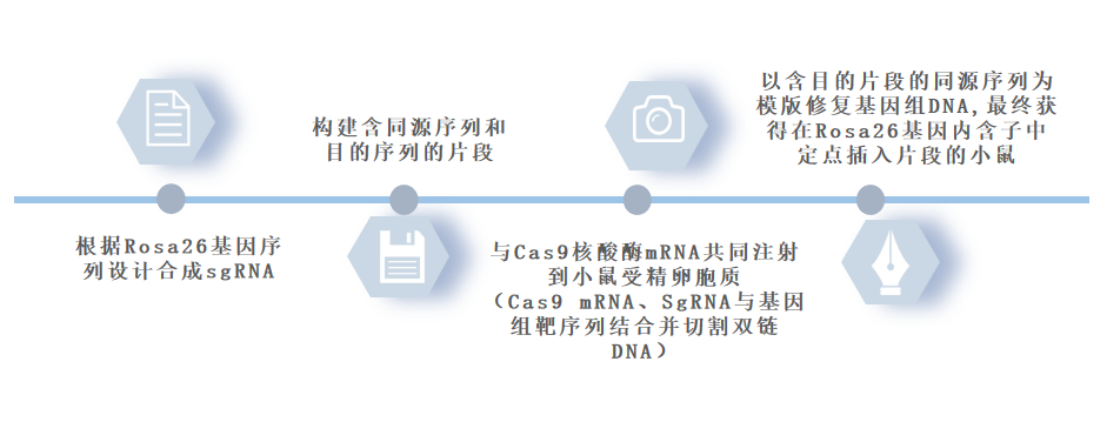
构建流程:
技术优势:
1. 外源基因的重组位置确定,更有利于表达;
2. 结合Cre-loxP系统,可以使外源基因在特定组织及特定时间表达;
H11位点基因敲入小鼠
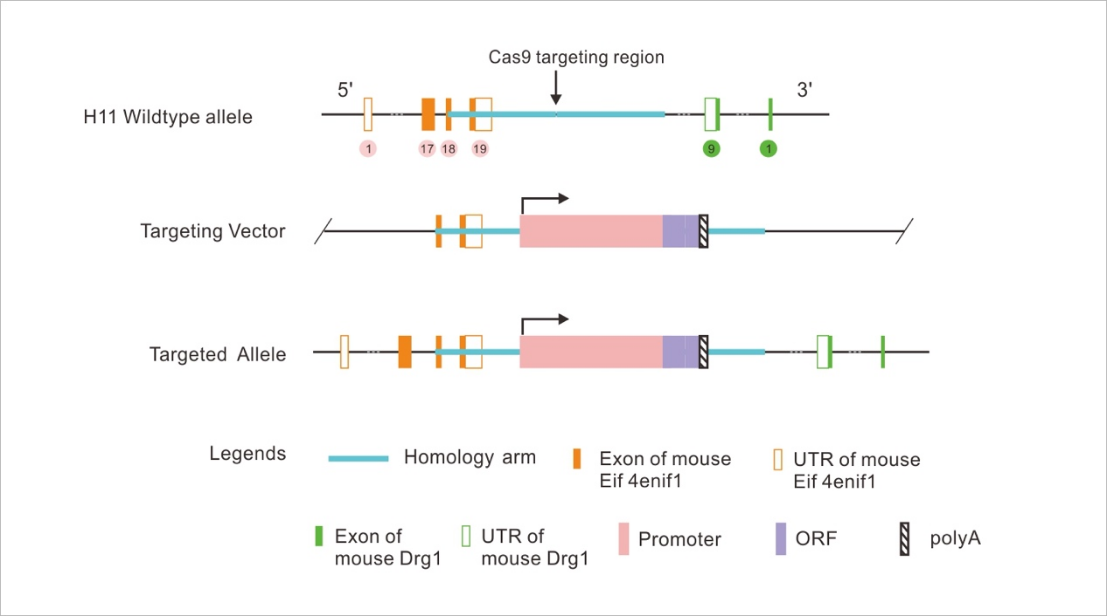
Rosa26是一个经典的基因插入位点,虽然对于Rosa26位点的研究较多,但制作多基因插入小鼠时仍需要其他合适的插入位点。H11(Hipp11)是另一个可供选择的插入位点,也是一个安全区域,在此位点的插入基因不会影响其他基因表达,同时此插入基因的表达也不会受到周边区域的影响。
H11位于小鼠 11 号染色体,是位于Eif4enif1与Drg1两个基因之间的一个位点,于 2010 年由 Hippenmeyer S.发现,整合到 H11 位点的外源基因可以稳定高效的表达。利用Crispr/Cas9基因编辑技术,可将外源的基因片段定点插入到小鼠的H11位点。与Rosa26相比,其优点是不受旁侧启动子影响,因此更合适用于表达外源基因。结合loxp系统,可构建组织特异性表达小鼠模型。
构建原理图:
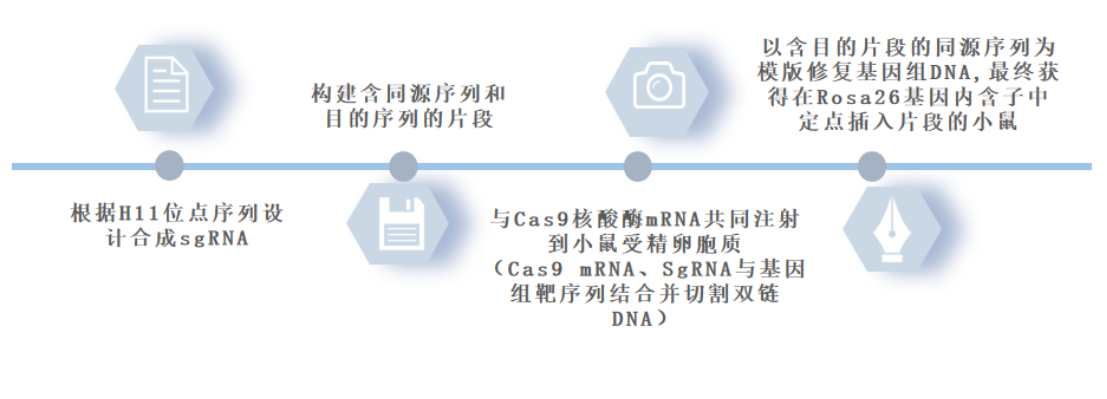
构建流程:
技术优势:
1. 稳定性高,后代表达一致;
2. 实用性强,能实现A基因在Rosa26位点及B基因在H11位点同时过表达;
3. 经济实惠,F1代即可开始实验。